Metode pemisahan campuran yang kita kenal mungkin ada bermacam-macam dimana sebagian sudah pernah dibahas, antara lain melalu filtrasi, sentrifugasi, dll.
Nah kali ini kita akan membahas metode pemisahan yang lainnya yaitu destilasi.
Bagi teman-teman yang belajar di Sekolah Menengah Atas Kimia ataupun belajar di bangku kuliah di jurusan kimia, dan farmasi tentunya tidak asing dengan metode ini.
Lalu apa pengertian destilasi, bagaimana prinsip kerjanya, apa saja macamnya, serta gambar rangkaian alatnya?
Yuk kita pelajari bersama
Daftar Isi
Destilasi Adalah Salah Satu Metode Pemisahan
Destilasi adalah suatu proses yang bertujuan untuk memisahkan suatu substansi dari campurannya atau memisahkan suatu substansi yang mudah menguap dari substansi lain yang relatif tidak menguap.
Proses destilasi terbagi menjadi 3 tahap, yaitu :
- Mengubah substansi dalam bentuk uapnya, misalnya : awalnyan adalah cair, maka harus dibuat dalam bentuk uap.
- Memindahkan uap yang telah terbentuk
- Mengkondensasikan uap yang terbentuk menjadi cairan kembali.

Semua zat cenderung untuk melepaskan molekulnya dari permukaan untuk menjadi bentuk uapnya.
Misalnya : Air yang molekul H2O tumpah di lantai atau dimeja, maka air tersebut akan menguap. Seperti kita ketahui air yang tumpah tersebut tentunya molekulnya banyak, maka masing-masing molekul tadi ingin melepaskan diri dari permukaan.
Oleh karena disitulah terjadi penguapan.
Dan penguapan tersebut temperaturnya tidak harus terjadi pada titik didihnya. Pada suhu berapa pun molekul bisa menguap. Terkait dengan temperatur hanya berdampak pada cepat dan lambatnya proses penguapan saja. Jadi pada temperatur kamarpun air bisa menguap.
Kemampuan untuk melepaskan molekul tergantung pada tenaga kohesi atau gaya tarik menarik dari senyawa yang itu sendiri, misalnya : antar molekul air, antar molekul etanol.
Semakin besar tenaga kohesi, maka semakin kecil kemampuan senyawa tersebut untuk melepaskan molekul dari permukaannya.
Contoh :
Jika kita bandingkan air dan etanol maka molekul-molekul etanol tersebut lebih cenderung mempunyai tenaga kohesi yang lebih kecil dibandingkan dengan tenaga kohesi air.
Atau dengan kata lain air tarik menariknya lebih tinggi dari masing-masing molekul dari etanol.
Itu juga yang menjadi jawaban, jika tangan kita semprot dengan menggunakan etanol maka akan lebih cepat menguap dibandingkan dengan kita semprot dengan air.
Baca Juga : Mengenal Kode Warna Botol Semprot Kimia di Laboratorium
Apabila suatu wadah tertutup kemudian diisi cairan tidak penuh (dibagian atasnya ada ruang yang kosong) maka cairan akan melepaskan molekul-molekul keruangan yang ada di atasnya atau akan mengisi ruangan kosong tersebut.
Misalnya kita punya satu gelas air dimana di dalam gelas yang tidak terisi penuh kemudian kita tutup di atasnya.
Nah nanti air yang ada di gelas tersebut molekul-molekulnya akan berusaha untuk menguap. Sehingga terkadang jika kita ambil tutup gelas tersebut terkadang kita lihat di atasnya ada titik-titik air.
Nah itu menunjukkan bahwa molekul-molekul tersebut berusaha untuk melepaskan diri antar molekulnya dan mengisi ruang kosong di atasnya.
Tekanan uap
Jika cairan didiamkan dalam bejana tertutup maka cairan akan menguap dan penguapan akan terhenti pada tekanan tertentu dan hanya tergantung pada suhu.

Jadi misalnya gelas,diisi air setengahnya saja kemudian ditutup. Nah molekul-molekul air itu akan berusaha untuk lepas atau menguap.
Kapan berhentinya ?
Sampai disebut dengan uap jenuh.
Nah misalnya ditutupnya kurang rapat maka nanti lama-lama uap juga akan keluar.
jadi kalau kita punya minuman kita taruh di botol lama sekali tidak kita buka maka sebenarnya uap yang berada diatas berusaha untuk melepas diri.
Pada suhu tertentu, tekanan uap senyawa cair yang bersinggungan dengan cairan adalah tetap, tidak tergantung pada jumlah cairan maupun adanya uap dalam sistem tersebut.
Tekanan uap air dilihat dari tinggi raksa dalam kolom satuannya dalam mmHg.
Hubungan Antara Suhu dan Tekanan
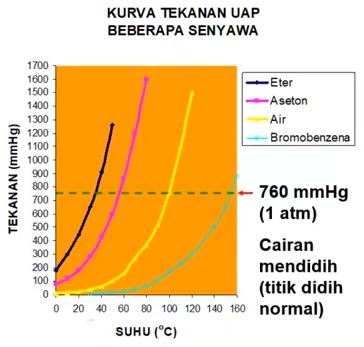
JIka kita lihat kurva hubungan antara suhu dan tekanan diatas, dimana tekanan udara 1 atmosfer (760 mmHg), maka dalam kondisi tersebut air mendidih pada suhu 100 °C.
Jika tekanannya direndahkan misalnya tekanannya 400 mmHg, maka air tersebut akan mendidih pada suhu 80 °C.
Demikian sebaliknya, jika tekanannya ditinggikan misalnya : 1200 mmHg, maka air akan mendidih diatas 100 °C. Demikian juga untuk pelarut-pelarut yang lain.
Tentunya kita ingat dengan rumusan PV = NRT, Jadi kalau kalau tekanannya tinggi, suhunya juga tinggi.
Nah hal diatas bisa dimanfaatkan untuk beberapa aplikasi, misalnya kalau tekanan tinggi.
Misalnya kita ingin supaya daging cepat empuk, maka tekanannya diperbesar supaya air tadi mendidih di suhu lebih tinggi dari 100 °C sehingga dagingnya cepet empuk.
Kemudian cara yang lain kita memanfaatkan vakum supaya tekanannya rendah karena jika tekanan rendah maka titik didihnya menjadi lebih rendah dan zat itu tidak rusak.
Contoh : jika kita ingin membuat keripik buah-buahan.
Jika keripik tempe keripik, singkong, pisang dengan digoreng pada tekanan 1 atmosfer sudah bisa menjadi keripik / menjadi keras karena airnya sudah bisa menguap.
Namun untuk buah-buahan karena kandungan airnya banyak, misalnya : kita mau menggoreng salak (membuat keripik salak)
Apakah dengan menggoreng salak, air yang ada didalam salak tadi hilang?
Tidak, malah lembek karena kadar air salak tinggi.
Maka untuk membuat keripik buah tersebut yaitu dengan cara pengurangan tekanan sehingga air yang air yang ada di dalam buah-buahan itu akan menguap tanpa merusak buah tersebut (aromanya masih ada, rasanya juga masih utuh)
Jadi kalau nanti kita mengeluarkan atau menguapkan pelarut pada saat ekstraksi, supaya zat yang kita ekstraksi tadi tidak rusak maka dilakukan destilasi vakum, contohnya etanol bisa menguap pada suhu dibawah suhu didihnya di tekanan atmosfer.
Titik Didih

Menguap adalah terjadi hanya pada permukaan cairan dan dapat terjadi pada setiap temperatur.
Jadi menguap itu pasti terjadi di permukaan, yang bagian dalam tidak menguap, tapi nanti yang bagian dalam pada akhirnya menjadi bagian permukaaan karena yang bagian di muka tadi sudah hilang.
“Jadi penguapan itu hanya pada permukaan cairan bukan yang di dalam”
Mendidih dapat terjadi pada setiap bagian dari cairan pada temperatur dimana tekanan uap cairan ditempat tersebut.
Jadi mendidih bisa terjadi disemua bagian cairan baik di bagian diatas, dibawah Tengah, dibagian bawah semua bisa mendidih.
Dapat terjadi pada setiap bagian dari cairan pada temperatur dimana tekanan uap cairan ditempatkan tersebut sama dengan tekanan udara di atas permukaan cairan plus tekanan cairan diatasnya yaitu temperaturnya sama dengan temperatur titik didih.
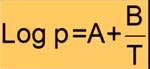

Rumus diatas adalah perhitungan titik didih pada tekanan tertentu yakni :
- P adalah tekanan uap
- T adalah suhu mutlak
- A dan B adalah tetapan
Perhitungan Titik Didih pada Tekanan Tertentu
Pada destilasi dibawah tekanan atmosfer. tekanan Barometer jarang tepat 760 mmHg, biasanya deviasi sekitar 20 mmHg. Maka disini harus dilakukan koreksi titik-titik terhadap tekanan normal dengan rumus :
![]()
Δt adalah koreksi terhadap titik didih yang teramati dalam °C.
Jika tekanannya tepat 760 mmHg maka memang mendidihnya di 100 °C (misalnya dalam air), namun jika misalnya tekanan udaranya tidak 760 mmHg maka cara menentukan berapa temperatur mendidih adalah dengan ditambahkan selisihnya (Δt)
Untuk alkohol, asam, dan cairan terasosiasi menggunakan persamaan berikut :
![]()
Lewat Panas
Temperatur pada bagian cairan yang letaknya jauh dari permukaan, harganya lebih tinggi dari titik didih cairan tersebut sehingga kelebihan panas yang timbul karena tekanan cairan di atas bagian tersebut.
Misalnya kita merebus air dalam panci, temperatur didih pada bagian atas tentunya lebih rendah daripada yang di bagian bawah Karena di bagian bawah tentunya tekanannya akan lebih tinggi daripada yang di bagian atas sehingga titik didihnya menjadi berbeda.
Cairan yang mempunyai temperatur lebih tinggi dari titik didih tersebut merupakan cairan yang akan mengalami superheating, jadi panasnya itu berlebih.
Kenapa kita pelajari hal tersebut?
Karena nanti terkait dengan destilasi dimana destilasi harus dipanaskan sehingga kita harus mengetahui sifat-sifat zat ketika dipanaskan.

Adanya perbedaan tekanan dan temperatur yang besar diantara bagian cairan akan menimbulkan percikkan kuat atau ledakan yang disebut sebagai disebut bumping.
Kalau di rumah misalnya kita merebus air dan jika sudah mendidih maka ditunjukkan dengan meletup-letup. Nah itulan ilustrasi yang disebut dengan bumping.
Hal tersebut karena titik didih di bagian permukaan dan di bagian bawah itu berbeda, dimana yang di bagian atas titik didihnya lebih rendah sedangkan di bagian bawah titik didihnya lebih tinggi karena tekanannya lebih besar.
Nah pada destilasi jangan sampai terjadi bumping karena jika terjadi bumping dikhawatirkan ada ledakan sehingga harus dihindari.
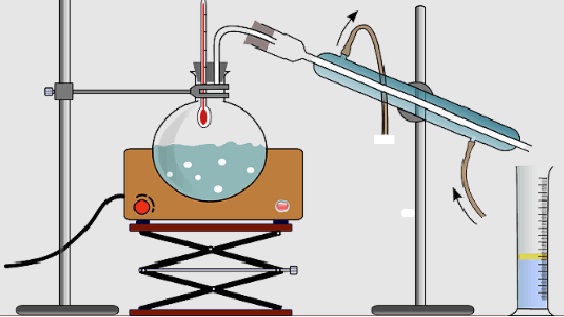
Pemasangan Labu Destilasi

Dari gambar diatas ini mana yang benar pemasangannya?
Pada gambar paling kiri panasnya hanya bagian bawah saja tidak merata sehingga kemungkinan untuk bumping lebih besar
Pada gambar yang ditengah, pemanas mantel sudah bisa menutupi bagian permukaan dari labu destilasi sehingga panasnya akan lebih baik.
Sedangkan gambar paling kanan menggunakan penangas, cairan di dalam labu destilasi harus mempunyai titik didih lebih rendah daripada airnya (misalnya cairan yang didestilasi ethanol dan cairan yang di penangas berupa air). Jadi jangan sampai misalnya yang di labu destilasi minyak, kemudian yang di bagian penangasnya berupa air.
Catatan :
Untuk etanol jangan sampai diberi pemanasan dengan api langsung atau harus menggunakan penangas air supaya tidak ada dari kebakaran.
Jadi pelarut-pelarut yang mudah terbakar, apalagi untuk pelarut yang titik didihnya dibawah titik didih air maka kita bisa menggunakan air dalam penangas.
Jadi pada gambar diatas, gambar paling kiri tidak benar
Kemudian dapat dilihat pada gambar diatas labu destilasi dimana terdapat pendingin dimana pada pendingin tersebut diberi air kran dari bagian bawah dan keluar dari bagaian atas.
Pastikan tidak dibalik karena nanti air tidak bisa memenuhi bagian pendingin.
Seberapa Besar Kecepatan aliran airnya?
Kita bisa pegang kondensornya (pendinginnya), jika dingin berarti kecepatan aliran air sudah tepat, namun jika masih terasa panas berarti kecepatan yang kurang.
Pengaturan kecepatan air ini tentunya penting, karena jika terlalu cepat juga sayang airnya terbuang cuma-cuma karena hanya untuk mendinginkan saja.
Panjang pendeknya kondesor juga tergantung titik didih dari zat atau pelarut yang di labu destilasi.
Jika titik didihnya lebih tinggi, maka cukup menggunakan kondensor yang pendek, namun jika titik didihnya rendah maka kita harus menggunakan kondensor yang lebih panjang karena proses kondensasi untuk yang titik didih rendah lebih membutuhkan waktu untuk kembali ke labu destilasi.
Bagaimana cara menghindari Bumping

- Dengan penambahan batu didih
Batu didih bisa pecahan porselen, teflon, atau pipa kapiler
Jadi jika di laboratorium kita punya porselen yang pecah maka jangan dibuang karena bisa digunakan untuk batu didih. Jadi pecahan itu mungkin kita ambil 3 sampai 5 untuk batu didih kemudian batu didih tersebut dimasukkan terlebih dahulu sebelum kita melakukan destilasi
- Pengadukan
Dengan pengadukan maka bumping bisa dihindari.
Contoh saat aktivitas memasak di rumah dimana terdapat bahan yang sudah mendidih karena panas dan bisa jadi tumpah, maka untuk menghindarinya bisa kita lakukan pengadukan.
- Pemanasan yang merata dengan penangas
Pemanasan yang merata dengan memberikan mantel atau menggunakan penangas
- Mengisi labu tidak boleh lebih dari 2/3 nya
Jangan terlalu penuh tapi juga jangan terlalu sedikit
Pada proses destilasi, penunjukan titik didih yang tetap sehingga destilasi mempunyai komposisi yang tetap pula. Jadi nanti selama pelarut belum selesai terdestilasi maka termometer tetap menunjukkan angka yang sama, misalnya 70 °C untuk etanol, dan jika sudah berubah ke suhu yang lain berarti destilatnya bukanlah lagi etanol.
Penunjukkan yang tetap tidak berarti destilat yang diperoleh murni, tetapi merupakan campuran azeotrop, cairan yang murni selalu selalu menunjukkan titik didih yang tetap.
Proses Destilasi

Pada proses destilasi, uap yang telah terjadi perlu diangkat untuk dapat mencapai pipa samping. Untuk itu diperlukan tenaga berupa panas.
Jumlah panas yang diperlukan untuk melawan tekanan udara luar, tinggi cairan, dan mengangkat uap untuk dapat mencapai pipa samping adalah besar.
Cairan selalu mempunyai temperatur yang tinggi dari titik didihnya sehingga pada proses destilasi selalu didapatkan cairan mengalami superheating.
Uap yang telah mencapai pipa samping dengan sistem pendingin dikondensasi menjadi cairan kembali.
Macam-macam destilasi
- Destilasi sederhana atau simple destilation
- Destilasi fraksinasi atau destilasi bertingkat
- Destilasi uap atau steam distillation
- Destilasi dengan penurunan tekanan atau vacuum destilation
Destilasi Sederhana

Destilasi sederhana dilakukan untuk memisahkan substansi dari campurannya yang mempunyai perbedaan titik didih lebih besar dari 30 °Celcius atau jumlah kotoran atau komponen lainnya relatif kecil.
Misalnya dua pelarut yang mempunyai titik didih ≥ 30° baru yang dilakukan destilasi sederhana
Untuk cairan yang mudah menguap, penampungnya dihubungkan dengan pendingin dengan menggunakan adaptor dan adaptor ini diberi slit supaya destilatnya bisa masuk ke dalam penampungnya dengan lancar.
Untuk cairan yang uapnya mudah terbakar atau beracun, diusahakan agar uapnya tidak sampai keluar ke udara bebas dari penampung yang dipakai.
Misalnya : destilasi eter maka diupayakan jangan sampai uapnya memenuhi udara di laboratorium sehingga harus dilakukan tindakan preventive misalnya : penampungnya harus dingin sehingga diberi es supaya nanti tidak menguap.
Baca Juga : Pengertian CAPA (Corrective Action and Preventive Action)
Diagram Fasa Campuran Etanol-Air

Misalnya 100 % air yang mempunyai titik didih 100 °C kemudian 100 % etanol mempunyai titik didih 78,5 derajat celsius.
Misalkan akan dipisahkan campuran etanol dan dan air dengan komposisi C1, akan mendidih pada suhu tertentu dan menghasilkan uap dengan komposisi C2.
Ketika uap itu mengembun, masih memiliki komposisi C2, jika dididihkan lagi akan menghasilkan uap baru dengan komposisi C3
Dengan urutan mendidih-kondensasi-mendidih akan berakhir dengan uap dan komposisi etanolnya adalah 95,6 persen
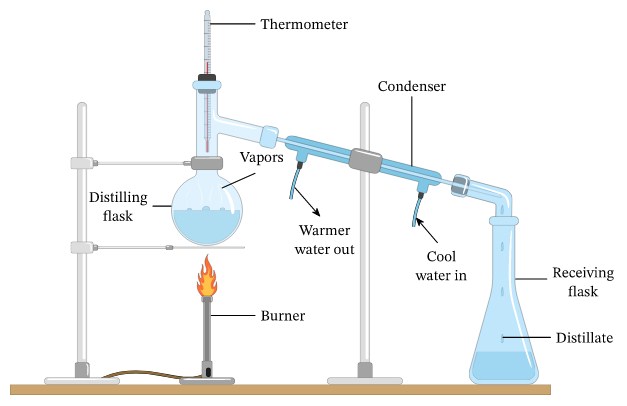
Rangkaian Alat Destilasi Sederhana

Diatas merupakan gambar rangkaian alat destilasi sederhana
- Termometer
Termometer dipasang di Persimpangan dan tidak boleh terlalu dalam atau masuk ke labu alas bulat (lihat tanda merah pada gambar diatas)
Baca Juga : Termometer Raksa, klinis dan Alkohol : Apa Kelebihan dan Kekurangannya?
- Labu Alas Bulat
Ada labu alas bulat dimana bagian lehernya panjang dan leher pendek, tergantung titik didih campuran atau larutan yang akan dipisahkan. Jika titik didihnya tinggi maka cukup menggunakan labu alas bulat yang lehernya pendek saja, namun jika titik didihnya rendah maka gunakan labu alas bulat yang lehernya agak panjang.
- Larutan yang akan dipisahkan
Misalnya :campuran etanol dan air
- Batu didih
Supaya tidak terjadi bumping
- Penangas yang sesuai
Misalnya untuk etanol, maka penangasnya adalah air, Beberapa tahun yang lalu, untuk memanaskan labu destilasi pada proses destilasi, seringkali menggunakan pembakar bunsen. Untuk penangas saat ini umumnya menggunakan listrik sehingga temperaturnya bisa diatur.
- Pendingin
Panjang-pendeknya pendingin juga tergantung pada titik didih dari pelarut yang ingin dipisahkan,
Misalnya pelarut mempunyai titik didih yang sangat rendah, contoh : eter, maka dibutuhkan pendingin yang panjang.
Demikian juga sebaliknya, jika titik didihnya tidak terlalu rendah maka pendingin yang digunakan boleh tidak terlalu panjang.
Pada pendingin tersebut dialirkan air dari bawah yang kemudian keluar dari bagian atas.
- Adaptor
Supaya destilatnya dapat masuk ke dalam labu erlenmeyer.
Pada adaptor terebut sebaiknya dipasang slit atau celah supaya nanti destilatnya bisa semua masuk labu erlenmeyer tersebut.
Jika tidak pasang celah, maka tetesan tidak bisa masuk ke labu erlenmeyer atau tertahan karena di labu erlenmyer hampa.
Kapan Menampung Destilat?

Pada contoh kali ini, misalnya kita akan memisahkan campuran etanol-air.
Ketika labu alas bulat yang berisi campuran etanol-air tersebut dipanaskan pelan-pelan, maka temperatur pada termometer tentunya semakin lama semakin naik.
Ketika temperaturnya menunjukkan angka tertentu, misalnya pada temperatur yang bukan titik didih etanol (namun titik didih yang lainnya) dan sudah ada destilatnya, maka berarti destilat tersebut bukanlah etanol sehingga destilat tersebut harus dipisahkan tempatnya atau diberi tempat yang berbeda.
Sedangkan untuk etanol adalah pada sekitar temperatur 70 an °C.
Selama etanol dalam campuran tersebut belum belum habis, temperaturnya tetap menunjukkan angka tersebut sehingga destilatnya masih kita tampung pada labu erlenmeyer.
Kemudian ketika temperatur lebih tinggi dari titik didih etanol, maka destilatnya bukanlah lagi etanol dan labu erlenmeyer yang digunakan untuk menampung distilat etanol bisa diambil dan pemanasan dihentikan.
Menghentikan Proses Destilasi

Untuk menghentikan proses destilasi apakah dimatikan terlebih dahulu penangasnya atau diambil terlebih dahulu labu erlenmeyernya?
Jika seandainya penangasnya dimatikan terlebih dahulu, maka kemungkinan uap yang ada di adaptor bisa balik ke labu alas bulatnya, karena tekanan uapnya juga berubah dimana yang awalnya tekanan di labu destilasi tinggi tiba-tiba menjadi rendah karena penangasnya dimatikan.
“Sebaiknya labu erlenmyer atau destilat tersebut yang diambil terlebih dahulu, baru penangasnya dimatikan sehingga tidak terjadi penyedotan kembali destilat ke arah labu alas bulat”
Pelaksanaan Destilasi Sederhana
Beberapa peraturan yang perlu diperhatikan :
- Ujilah terlebih dahulu kekuatan pemasangan alat.
Untuk memperkuat rangkaian peralatan destilasi, umumnya menggunakan bantuan klem dan statif.
- Masukan cairan dengan bantuan corong bertangkai panjang agar cairan tidak mengotori pipa samping.
Corong bertangkai panjang digunakan karena jika kita menggunakan corong bertangkai pendek cairan dapat masuk pipa samping sehingga cairan tidak terpisah.
- Masukkan beberapa butir batu didih
Seperti yang sudah diuraikan di awal, dimana fungsi batu didih ini adalah untuk mengurangi potensi bumping
- Alirkan air pendingin dimana lubang air masuk lebih rendah dari air keluar dengan kecepatan demikian rupanya sehingga selama destilasi berlangsung dinding luar pendingin tetap terasa dingin.
Jadi dicek alirannya itu cukup atau tidak, jika pendinginnya masih terasa panas berarti kecepatan aliran air harus ditambah, namun perlu diperhatikan jika terlalu besar alirannya maka juga tidak menghemat air.
- Lakukan pemanasan dengan pelan dan teratur agar cairan mendidih dengan teratur pula.
Aturlah pemanasan hingga diperoleh kecepatan destilasi 1 – 2 ml (30 – 60 tetes) per menitnya.
Destilasi dihentikan sebelum cairan di dalam labu habis. Hal ini dilakukan untuk menghindari peruraian dan kehangusan. Destinasi dihentikan jika temperatur pada termometer telah berubah dari temperatur titik didih destilat.
Jika temperatur sudah berubah berarti senyawa hasil destilasi (destilat) sudah bukan senyawa yang ingin kita pisahkan
Apabila cairan yang didestilasi mengandung sedikit kotoran maka mula-mula yang didapatkan adalah destilat I (low boiling fraction) mengandung kotoran dengan titik didih yang lebih rendah.
Kemudian temperatur terus naik sampai dicapai temperatur yang relatif konstan bervariasi antara 2 – 3 derajat Celcius sehingga diperoleh destilat utama.
Selanjutnya temperatur naik lagi hingga didapatkan destilat yang dikotori dengan kotoran yang memiliki titik didih yang lebih tinggi (high boiling fraction)
Destilasi Fraksinasi

Merupakan pengulangan berkali-kali destilasi sederhana untuk mendapatkan destilat yang relatif murni.
Destilasi ini menggunakan kolom fraksi
Kolom fraksi untuk memisahkan suatu campuran menjadi komponennya dengan pertolongan suatu kolom fraksi.
Prinsip kerjanya adalah “bubble plate colomn” dapat dilihat pada gambar berikut :

- A bidang 2 horizontal menampung destilat
- B Kap tempat uap air naik
- C Pipa Kapiler
Pada permulaan destilasi, uap akan naik dari labu masuk ke dalam kap dan mengkondensasi pada bidang A yang I (pertama)
Penguapan dan pengkondensasian terjadi secara berkesinambungan dan terus naik melalui kap dan menembus destilat-destilat yang telah terjadi.
Permukaan destilat yang terjadi pada bidang A yang I akan naik sampai permukaan pipa kapiler kemudian jatuh ke labu.
Semakin ke atas titik didih semakin kecil karena kalau titik didihnya lebih besar maka tidak akan bisa mencapai paling atas.
Prinsip Kerja Destilasi Fraksinasi
Destilat pada pada bidang A yang I pada destilasi sederhana adalah fraksi dengan komposisi lebih banyak komponen titik didih rendah, sehingga yang tertinggal dilabu lebih banyak komponen dengan titik didih yang lebih tinggi akibatnya titik didih cairan di dalam labu semakin naik.
Uap yang naik dari labu mendidihkan destilat bidang A yang I sehingga uap akan naik melalui kap 2 dan mengkondensasi di bidang A yang ke II.
Jumlah komponen titik didih rendah di bidang A II lebih besar daripada A I, dst
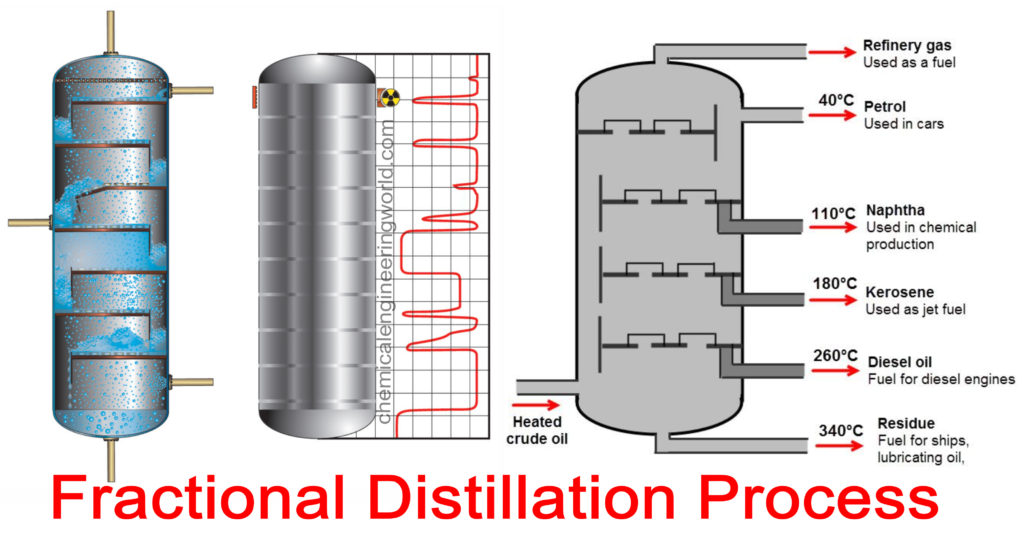
Contoh destilasi fraksi adalah distilasi bertingkat minyak bumi.

Ketika crude oil masuk, dan kemudian dilakukan pemanasan kemudian tidak mampu untuk naik ke atas, maka akan turun kebawah menghasilkan bahan yang mempunyai rantai karbon lebih dari 70 dimana mendidih pada 600 °C.
Kemudian yang masih sanggup naik maka menghasilkan bahan yang mempunyai rantai karbon antara 20 – 70 dan bisa dimanfaatkan untuk minyak pada kapal.
Dan seterusnya sampai didaptkan elpiji.
Destilasi Tiksotropi atau Destilasi Uap Air

Destilasi uap-air adalah metode yang paling umum untuk ekstraksi minyak atsiri seperti kayu, Kulit batang, maupun biji-bijian yang relatif keras.
Prinsip kerja dari destilasi uap adalah memisahkan suatu campuran yang memiliki titik didih yang tinggi dengan cara mengalirkan uap ke dalamnya dimana senyawa yang memiliki titik didih yang tinggi sebelum mencapai titik didihnya dimurnikan dengan menggunakan uap atau air mendidih.
Destilasi uap secara umum digunakan untuk destilasi campuran air dengan senyawa yang tidak larut dalam air.
Beberapa persyaratan sampel yang bisa dipisahkan menggunakan metode ini yaitu :
- Kemampuan tinggi untuk melarutkan komponen zat terlarut di dalam campuran
- Kemampuan tinggi untuk dapat diambil kembali
- Perbedaan berat jenis antara ekstrak dan rafinat lebih besar
- Pelarut dan larutan yang akan diekstraksi harus tidak mudah campur
- Tidak mudah bereaksi dengan zat yang akan diekstraksi
- Tidak merusak alat sebagai korosi
- Tidak mudah terbakar, tidak beracun, dan harganya relatif murah
Contoh Destilasi Uap Air di Bidang Farmasi
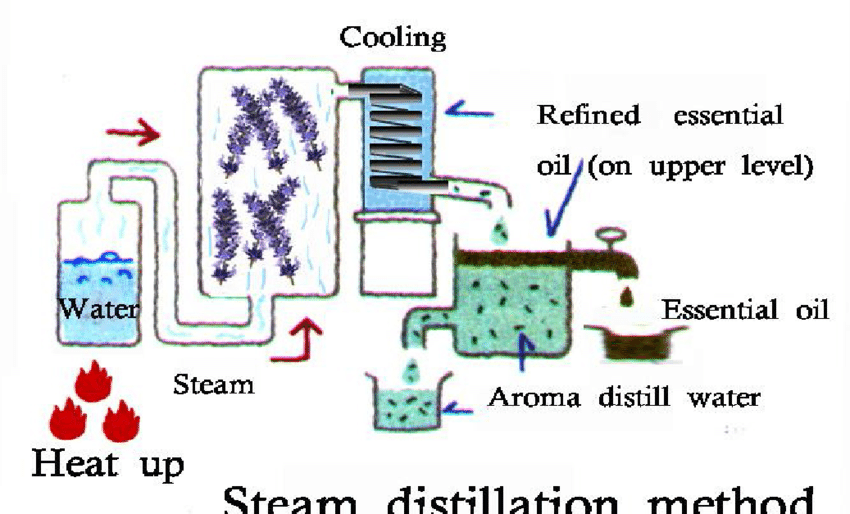
Beberapa penggunaan dari destilasi uap-air adalah untuk :
- Mengekstrak beberapa produk alam seperti minyak Eucalyptus dari Eucalyptus.
- Mengekstrak minyak sitrus dari lemon atau jeruk
- Mengekstrak minyak parfum dari tumbuhan.
- Memisahkan asam lemak dari campurannya
- dll
Destilasi Vakum
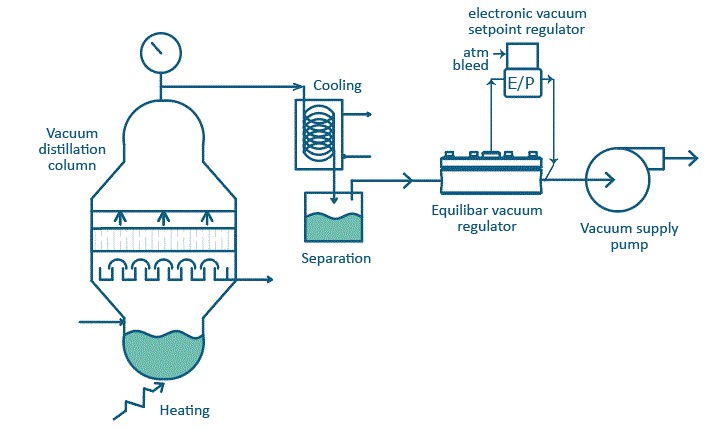
Destilasi vakum merupakan suatu proses pemisahan dari dua komponen yang memiliki titik didih yang sangat tinggi, dimana prosesnya berlangsung di bawah tekanan normal atau dibawah 1 atm yang bertujuan untuk menurunkan titik didih dari komponen yang akan dipisahkan sehingga akan meminimalisasi kerusakan komponen akibat suhu tinggi.
Vakum merupakan suatu kondisi dari udara atau gas sekitar lingkungan tertentu dimana dihilangkan, dimana tekanan udara di bawah tekanan atmosfer.
Untuk menghasilkan kondisi vakum perlu untuk mengeluarkan udara dari sistem. Hal ini merupakan prinsip dasar dari cara kerja vakum.
Prinsip Kerja Destilasi Vakum
Prinsip kerja destilasi vacuum didasarkan pada hukum fisika dimana zat cair akan mendidih dibawah titik didih normalnya apabila tekanan pada permukaan zat cair itu diperkecil atau vakum.
Prinsip kerja dari destilasi vakum ialah dimana proses destilasi berjalan tetap pada ruang hampa. Aliran cairan dan uap air sangat diperlukan pada proses ini untuk mencapai keseimbangan dimana pada proses tersebut untuk menguapkan komponen yang mudah menguap dan uap air dipermudah pada destilasi sistem vakum.
Tangki distilasi tidaklah terhubung ke atmosfer tetapi ke pompa vakum untuk menjaga sistem tekanan agar tetap dibawah tekanan atmosfer.
Contoh Destilasi Vakum
Destilasi vakum sangat berguna untuk senyawa yang mendidih di luar suhu dekomposisi pada tekanan atmosfer dan karenanya akan terurai dengan upaya apapun untuk merebusnya dibawah tekanan atmosfer.
Dalam skala laboratorium penyulingan vakum adalah ketika cairan untuk disuling memiliki titik didih atmosfer tinggi atau perubahan kimia pada suhu mendekati titik didih atmosfer.
Dalam skala industri penyulingan memiliki beberapa keunggulan, salah satunya adalah alat yang digunakan mengurangi jumlah tahapan yang diperlukan.
Vakum kolom destilasi biasa digunakan dalam penyulingan minyak dengan diameter berkisar sampai 14 m.
Kelebihan dan Kekurangan dari destilasi vakum
Destilasi vakum dapat meningkatkan pemisahan dengan :
- Pencegahan degradasi produk atau pembentukan polimer karena penurunan tekanan yang mengarah ke suhu dasar menara yang lebih rendah.
- Pengurangan degradasi produk atau pembentukan polimer karena berkurangnya waktu tinggal rata-rata terutama dalam kolom yang menggunakan pengepakan daripada baki.
Baca Juga : Pengertian Polimer dan Polimerisasi Berikut dengan Contohnya
- Meningkatkan kapasitas, hasil, dan kemurniaan.
Memanfaatkan destilasi vakum dapat mengurangi tinggi dan diameter.
Kekurangannya ialah tutup mendidih campuran mungkin memerlukan banyak tahap kesetimbangan untuk memisahkan komponen-komponen.
Mekanisme Destilasi Vacuum
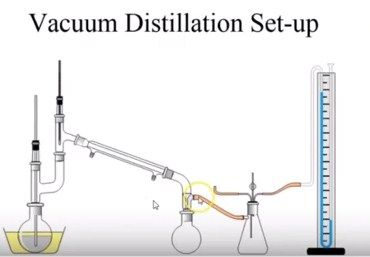
Dapat dilihat setup dari destilasi vakum atau rangkaian dari destilasi vakum pada gambar diatas.
Untuk rangkaiannya kurang lebih sama seperti deskripsi sederhana atau destilasi fraksinasi dimana terdapat labu destilasi yang terhubung dengan termometer yang juga terhubung dengan kondensor dan labu destilat.
Perbedaan pada sistem destilasi vakum adalah :
- Sumber vakum
Contoh sumber vakum yaitu :
-
- Water aspirator, dimana water aspirator ini terhubung dengan sistem air mengalir atau kran dimana kran yang terbuka tersebut akan menciptakan kecepatan dari air mengalir yang akan menarik udara sehingga tercipta tekanan yang rendah pada sistem destilasi.
Terdapat beberapa kelebihan dan kekurangan menggunakan water aspirator ini, antara lain :
Untuk kelebihannya adalah metode ini cukup murah dan mudah untuk digunakan dan efektif atau efisien dalam membuat vakum, namun kelemahannya adalah dapat terjadinya kebocoran pada sistem destilasi dan juga terdapat kemungkinan permasalahan dalam tekanan airnya dan membutuhkan vakum trap yang digunakan untuk mencegah terjadinya flowback atau air itu mengalir kedalam sistem destilasi.
-
- Pompa vakum
Dimana pompa vakum ini mempunyai kelebihan yaitu dapat menciptakan tekanan yang stabil stabil kemudian juga dapat menjauhkan tekanan yang cukup rendah sampai di bawah 1 mmHg namun untuk menggunakan pompa vakum ini dibutuhkan biaya yang cukup mahal.
- Vacuum Trap
Yaitu untuk mencegah terjadinya flowback atau air masuk kedalam sistem destilasi
- Pipa pada Labu Destilasi
Pipa ini berguna untuk mengatur aliran air yang ada pada sistem destilasi. Biasanya terdapat switch atau stopcock untuk mengatur pipa tersebut terbuka atau tertutup.
- Manometer (Jika memungkinkan)
Sebagai informasi, penggunaan manometer di beberapa negara sudah tidak diperbolehkan karena bahan-bahan merkuri ini dapat menyebabkan polusi dan kerusakan pada ekosistem.
Contoh Dalam Skala Laboratorium adalah Rotary evaporator.
Kesimpulan
Nah kita sudah belajar mengenai pengertian, macam, prinsip kerja, dan rangkaian alat destilasi beserta dengan contohnya.
Buat teman-teman yang tertarik bekerja di beberapa industri pemahaman ini penting karena ada beberapa contoh kegiatan produksi yang menggunakan prinsip kerja destilasi ini,, antara lain pada industri alkoho, pengolahan minyak atsiri, penyulingan minyak bumi, dll
Semoga Bermanfaat.